HEMATOLOGIA DEL CATAN (Astractosteus spatula), COLECTADOS EN EL NORESTE DE MEXICO.
HEMATOLOGY OF CATAN (Astractosteus spatula), COLLECTED IN NORTHEASTERN MEXICO.
Francisco Javier Alvarez Mendoza
Universidad Autónoma de Nuevo León
javieralva@hotmail.com
Jesús Montemayor Leal
Universidad Autónoma de Nuevo León
montemayorleal@yahoo.com.mx
Elsa María Tamez Cantú
Universidad Autónoma de Nuevo León
elsa.tamezcn@uanl.edu.mx
Resumen
Las poblaciones de catán (Atractosteus spatula), se han visto disminuidas drásticamente durante las últimas dos décadas en el noreste de México, debido principalmente a la captura, así como la perdida de hábitats por la actividad antropogénica y la contaminación. Por lo anterior es importante conocer su Biología y en particular su Hematología, ya que es un tejido que refleja en forma rápida cambios tanto intrínsecos como extrínsecos provocados por el medio ambiente. Los parámetros hematológicos estudiados fueron Hemoglobina (Hb,  =12,45gr/dl), Microhematocrito (Ht,
=12,45gr/dl), Microhematocrito (Ht, =44.33%) Leucocrito (Lc,
=44.33%) Leucocrito (Lc, = 2.76 %), Proteína Total del Plasma (PTP,
= 2.76 %), Proteína Total del Plasma (PTP, = 5.48 gr/dl), Recuento por Dilución de Glóbulos Rojos (RDR,
= 5.48 gr/dl), Recuento por Dilución de Glóbulos Rojos (RDR,  =1 004 000), Recuento por Dilución de Glóbulos Blancos (RDB,
=1 004 000), Recuento por Dilución de Glóbulos Blancos (RDB,  = 64 471). Las células cuantificadas para el recuento diferencial fueron: Trombocitos (
= 64 471). Las células cuantificadas para el recuento diferencial fueron: Trombocitos ( =46.5), Neutrofilos (
=46.5), Neutrofilos ( =4.5), Eosinofilos (
=4.5), Eosinofilos ( =3.14), Basofilos (
=3.14), Basofilos ( =3), Linfocitos (
=3), Linfocitos ( =26.6), Monocitos (
=26.6), Monocitos ( =5.42), Células Plasmáticas (
=5.42), Células Plasmáticas ( =6.56), Promielocitos (
=6.56), Promielocitos ( =1.67), Mielocitos (=0.31 ±
=1.67), Mielocitos (=0.31 ± 0.66), Células No Identificadas (
0.66), Células No Identificadas ( =1.25 ±1.33). Los valores hematológicos reportados concuerdan con los reportados para otros peces, no así la diversidad de los leucocitos.
=1.25 ±1.33). Los valores hematológicos reportados concuerdan con los reportados para otros peces, no así la diversidad de los leucocitos.
Palabras clave: Catán, Atractosteus spatula, Hematología, Leucocitos.
Abstract
Gar populations (Atractosteus spatula), have been decreased dramatically over the past two decades in northeastern Mexico, mainly due to the capture and loss of habitats by anthropogenic activity and pollution. Therefore it is important to know their biology and hematology in particular because it is a fabric which quickly reflects both intrinsic and extrinsic changes caused by the environment. The hematological parameters studied were hemoglobin (Hb = 12.45 g / dl), Microhematocrit (Ht, = 44.33%) Leucocrito (Lc, = 2.76%), Total Plasma Protein (PTP, = 5.48 g / dl), count by Dilution of Red Blood Cells (RDR = 1.004 million), Count White Blood Cell Dilution (RDB, = 64 471). Quantified cells for the differential count were: Platelets (= 46.5), neutrophils (= 4.5), eosinophils (= 3.14), basophils (= 3), Lymphocytes (= 26.6), Monocytes (= 5.42), plasma cells (= 6.56 ), Promyelocytes (= 1.67), Myelocytes (= 0.31 ± 0.66), Unidentified cells (= 1.25 ± 1.33). Haematological values reported are consistent with those reported for other fish, but not the diversity of leukocytes.
Key words: Catan, Atractosteus spatula, Hematology, Leukocytes.
Fecha recepción: Febrero 2010 Fecha aceptación: Abril 2010
Introducción
Los catanes o peces lagartos son organismos sumamente antiguos, con estructuras primitivas, que pueden considerarse verdaderos fósiles vivientes. Las primeras especies aparecieron en el Periodo Cretácico, 180 millones de años atrás, y florecieron en casi todo el mundo (excepto Asia), para luego disminuir hasta las siete especies divididas en dos géneros, los cuales aún prevalecen en Norte y Centro América. El “Catán” (Atractosteus spatula) presenta una distribución original que va desde los ríos Ohio y Missouri en los Estados Unidos hasta la Laguna de Tamiahua en Veracruz, México (Contreras-Balderas y Ruiz-Campos, 2010). Se le encuentra en pozas de los grandes ríos y en aguas salobres o marinas a lo largo de la costa del Golfo de México.
Las poblaciones de catán, se han visto disminuidas drásticamente durante las últimas dos décadas en el noreste de México, debido principalmente a la captura, así como la perdida de hábitats por la actividad antropogénica y la contaminación, por lo que su estado actual de conservación es considerado vulnerable (Jelks et al., 2008). Por lo anterior es importante incrementar los conocimientos sobre su Biología, en particular su Hematología, ya que es un tejido que refleja en forma rápida cambios tanto intrínsecos como extrínsecos provocados por el medio ambiente.
Antecedentes.
Wedemeyer (1977), citó una serie de métodos analíticos, junto con guías para colección de muestras y la interpretación de resultados, indicando pruebas hematológicas, de agua, hígado, y músculo, surgiendo un mínimo de 10 peces debido al gran coeficiente de variación que presenta el muestreo, para el monitoreo biológico de peces cultivados así como de poblaciones nativas para evaluar el efecto del estrés provocado por el medio ambiente en peces sanos.
Cameron (1970), encontró que los plaguicidas y otros contaminantes causan alteraciones en tejidos y sangre de peces. Por su parte, Christensen (1972), reportó que pequeñas cantidades de metales pesados como cobre, cromo, iones, de mercurio, en el ambiente acuático, causan múltiples cambios en el dinamismo interno de los organismos, inclusive letales.
Wydosky (1976), indicó que el metabolismo y la regulación iónica a través de la química sanguínea en peces, son medios de identificación de las condiciones anormales en el ambiente que producen estrés a peces. Concluyen que los peces son indicadores de la calidad del agua. Así mismo, Agrawal (1980), señaló que el manganeso es depositado en aguas dulces junto con fertilizantes, aditivos en alimentos y fungicidas y que los peces de agua dulce muestran un decremento significativo en la cuenta total eritrocitos cuando han sido expuestos a este.
Tomasso et al. (1981), en pruebas realizadas a bagres encontró que el calcio tuvo un efecto mínimo de toxicidad y el sodio mostró no tener efecto alguno sobre los peces. Mencionan que la toxicidad por nitritos está relacionada con la capacidad de oxidar la hemoglobina a metahemoglobina, perdiendo la capacidad de acarrear oxígeno a las células. Los efectos tóxicos del amonio en el medio ambiente son debido a una forma no ionizada; que en una exposición subletal causa daño al tejido de las branquias y riñones en un lapso de 24 hrs.
Garofano (1982), indicó que los peces se pueden usar como monitores de cuerpos de agua contaminados con cadmio. En su estudio revela que el cloruro de cadmio en altas concentraciones producen una baja de eritrocitos y un aumento en leucocitos en Ictalurus nebulosus. Prasad et al., (1987), estudio el efecto de diferentes concentraciones de extractos de petróleo crudo sobre el bagre (Heteropneustes fossilis), mediante el análisis hematológico, encontrando niveles bajos de hemoglobina, incremento en el hematocrito, hiperglicemia y aumento en la concentración del ácido ascórbico, demostrando también que los efectos son reversibles al regresar al bagre a su medio natural.
Alvarez-Mendoza (1997), reporta para la lobina negra (Micropterus salmoides), bajo condiciones de desnutrición moderada un microhematocrito (Ht) de 33.99%, hemoglobina (Hb) de 7.76 gr/100ml, y proteína total del plasma (PTP) de 4.56 gr/dl, y desnutrición severa Ht de 22%, Hb de 4.35 gr/100 ml y PTP de 3.72 gr/dl, mientras que el control presentó un Ht de 28.26%, Hb de 5.10 gr/100 ml y PTP de 4.31 gr/dl, concluyendo que lo parámetros hematológicos son alterados desde estadíos incipientes de desnutrición.
Lohner et al. (2001), evaluaron en poblaciones de peces sol (Lepomis sp.), colectados en el río Ohio y afluentes que reciben descargas de cenizas de carbón, y el efecto de bajas concentraciones de Se. Encontrando que la concentración de Se, Cu y As fueron estadísticamente altas en los tejidos de peces muestreados expuestos con respecto a los peces de referencia. Leucopenia, linfocitosis y neutropenia fueron evidentes en peces expuestos. Los valores del conteo de glóbulos blancos por dilución y el porcentaje de linfocitos fueron significativamente correlacionados con la concentración de Ser en el hígado. Los niveles de proteína en el plasma fueron significativamente menores en peces expuestos indicando que puede haber un estrés nutricional. El factor de condición y rango de crecimiento no presentaron diferencias significativas entre los peces expuestos y los de referencia, considerando a los parámetros hematológicos y el análisis de la concentración de Se en el hígado como herramientas de diagnóstico.
Lemly (2002), estudio las alteraciones producidas por él Se en las comunidades de peces del lago Belews en Carolina del Norte, encontrando: telangectacia en las lamelas branquiales, linfocitos elevados, anemia (reducción de hematocrito y hemoglobina), cataratas corneales, exoftalmia, alteraciones patológicas en el hígado, riñón, corazón y ovarios, fracaso en la reproducción (reproducción de huevos viables, debido a la patología del ovario, y mortalidad post-desove, debido a la bioacumulación de selenio en los huevos), teratogénesis de espinas, cabeza, boca y aletas. Encontrando que en los huevos una concentración de 10µg/g, o más de selenio, puede alterar las funciones bioquímicas, pasando por efectos teratogénicos, hasta causar la muerte. Por otro lado los adultos aparentan estar sanos pero fracasan en su reproducción, debido a la ingesta de selenio a través de las cadenas alimenticias acuáticas, que lo toman del sedimento del lago.
Sepúlveda et al. (2004), estudiaron la disfunción reproductiva en el róbalo (Micropterus salmoides floridanus), expuestos a agua de desecho de una industria papelera, en concentraciones de 10%, 20%, 40% y 80%, durante los períodos de 28 a 56 días, en estanques de estudio, además se colectaron róbalos en el rio St. Johns. Florida, donde descarga la planta de papel sus aguas residuales. Se realizaron análisis de sangre y plasma, además del estudio histopatológico del hígado y el bazo. En los peces confinados en estanques se determino un incremento en la concentración de albúmina e índice hepatosomático, para los róbalos expuestos a concentraciones de 20% o más en el período de 56 días. El índice bazosomático y los centros de melanomacrófagos decrecieron en róbalos colectados de sitios de corriente concentrada (Palataka y Rice Creek) considerando además que concentraciones de calcio, fósforo, glucosa y creatinina fueron elevados, comparado con peces de ríos de referencia. Los peces de Rice Creek presentaron disminución en la cuenta de glóbulos rojos por dilución, y los róbalos machos de Palataka menor concentración de colesterol. La concentración de albúmina del plasma y la concentración de Acido glutámico hepático fue elevado en róbalos machos de Palataka, y hembras y machos de Rice Creek tuvieron altas concentraciones de globulina. Indicando un patrón complejo del efecto de aguas residuales de la industria papelera en varias funciones fisiológicas, a pesar de ser tratadas previamente.
Silveire-Coffigny et al. (2004), estudiaron en Oreochromis aureus el efecto de diferentes condiciones de estrés, infección bacteriana, intoxicación por nitritos, dosis excesiva de verde de malaquita, su efecto en los índices hematológicos y su relación con la condición de salud. Los peces mostraron anemia microcítica bajo la infección bacteriana experimental por Corynebacterium sp.; anemia, neutrofiolia y deformación de eritrocitos por intoxicación de nitritos y dosis excesiva de medicación con verde de malaquita.
Beker, et al. (2005), compararon los parámetros hematológicos, Hematocrito, Hemoglobina, la Concentración Media de Hemoglobina, composición iónica, concentración de metabolitos y Proteína Total del Plasma, bajo condiciones de esfuerzo, en Acipenser oxyrinchus y Acipenser brevirostrum, encontrando diferencias en la osmolaidad del plasma, concentración de Na+, Cl¯, lactato, cortisol, y proteína total, el resto de los parámetros no presento diferencia significativa.
Jamalzadeh y Ghomi (2009), realizaron un estudio hematológico con Salmon trutta caspius, encontrando que en el invierno aumentan los monocitos, eosinofilos y neutrofilos con respecto a las otras estaciones del año. El valor del hematocrito, conteo por dilución de leucocitos, linfocitos y linfocitos grandes son mayores en los organismos pequeños que en los adultos.
Adeyeno et al. (2009), reportan cambios hematológicos en el bagre africano (Clarias garipinus), bajo condiciones simuladas de manejo y transporte, encontrando un incremento en los linfocitos, pero no hubo diferencia significativa en microhematocrito, hemoglobina, leucocitos y eosinofilos.
Galeano et al. (2010), reportan los valores hematológicos de Porichthys porosissimus, muestreados en Bahía Blanca, Argentina, lugar presionado por la contaminación urbana e industrial. Los valores para eritrocitos fueron de 1.32 ±0,32 x 106/µl, leucocitos 3314.8 ±2058.8 /µl, hemoglobina 8.13 ±1.18g/dl, hematocrito 36.17 ±6.03%, volumen corpuscular medio (VCM) 295.14 ±90.02fl, hemoglobina corpuscular media (HCM) 65.68 ±22.32pg, y una concentración de hemoglobina corpuscular media (CHCM) 23 ±4.92%. La proteína plasmática en otoño fue de 4.059 ±0.971 g/dl, y descendió en primavera a 2.477 ±0.369g/dl. Se describen seis tipos de células sanguíneas, eritrocitos, linfocitos, eosinofilos, neutrofilos, trombocitos y monocitos.
Akinrotimi et al., (2010), analizaron 60 ejemplares adultos de Tilapia guineensis reportando los siguientes valores hematológicos, hematocrito 22.67 ±2.14%, hemoglobina 7.72 ±1.20g/dl, leucocrito 7.81 ±1.14%, conteo por dilución de leucocitos 30.02 ±2.50 células x109 g/l, conteo por dilución de eritrocitos 2.58 ±0.69 células x109 g/l, trombocitos 40.65 ±3.14%, neutrofilos 20.45 ±2.21%, linfocitos 35.46 ±4.7% y monocitos 3.12 ±1.00%.
Material y Método.
Se trabajaron 33 ejemplares adultos de catán (Atractosteus spatula), para los parámetros de Hemoglobina (Hb,gr/dl), Microhematocrito (Ht,%), Leucocrito (Lc,%), Proteína Total del Plasma (PTP,gr/dl), Recuento por Dilución de Glóbulos Rojos (RDR, miles/mm3), y Recuento por Dilución de Glóbulos Blancos (RDB, miles/mm3). Se realizaron frotis de sangre de 36 ejemplares, reportando el recuento diferencial de leucocitos para cada uno de ellos.
La longitud de los peces fueron medidos con una cinta métrica (Slaymaker 10´ X ½´´), y pesados (Balanza Tor-Rey, Modelo EQ-10/20).
La muestra de sangre se obtuvo por punción cardiaca, debido a que los peces fueron sacrificados para hacer un estudio parasitológico paralelo. Para determinar la hemoglobina de utilizo un Hemoglobinometro (BMS, modelo AO), donde la sangre se hemoliza en un cámara del mismo equipo, con aplicadores que contienen saponina por 30 segundos, colocándose en el compartimiento indicado dentro del aparato y realizando la lectura correspondiente.
Para la prueba de microhematocrito y leucocrito se llenaron capilares heparinizados con ¾ de sangre, sellándose con creatoseal, se centrifugaron (Centrifuga Solt-Bat, modelo PL 16 Aparatos Científicos) a 11 000 rpm, por 5 minutos, midiendo en el lector para microhematocrito ambas pruebas. Hecho lo anterior, se procedió a seccionar la parte del capilar que contenía el plasma, y cuya muestra se coloco en un refractómetro (modelo A3000 CL Clinical, Japan), para hacer la medición de la proteína total del plasma por medio gravimétrico.
El recuento por dilución de Glóbulos Rojos se realizó usando un Hemocitometro y pipetas de Thoma para rojos, con el líquido diluyente de Hayem, siguiendo la metodología estándar. Para el recuento de Glóbulos Blancos se utilizó el Hemocitometro, pipetas de Thoma para blancos y líquido diluyente de Turk, siguiendo la metodología estándar.
Se realizaron frotis de sangre, los cuales fueron fijados en metanol por un tiempo mínimo de 5 minutos, procediéndose a colorear con hemocolorante rápido (HYLCEL No. 548) para realizar el recuento diferencial de leucocitos. Las observaciones se realizaron con microscopio de campo claro (Leica Modelo CME), utilizando objetivo de inmersión (100X), contando cien leucocitos, separándolos en sus porcentajes correspondientes.
Resultados.
Los peces analizados presentaron una longitud promedio de 67 cm, con un máximo de 72 cm, y un mínimo 60 cm. El peso presento una media de 2 245 gr, con un máximo de 2 800 gr y un mínimo de 1 700gr. (Tabla 1).
En los parámetros de la serie roja, la Hemoglobina (Hb) presento una media de 12.45 (±2.86), con un máximo de 17 y un mínimo de 5. Para el Microhematocrito (Ht) se reporta una media de 44.33 (±8.72), presentando un mínimo de 31 y un máximo de 63. El recuento por dilución de glóbulos rojos (RDR), presento un promedio de 1 004 000 (±562 078), con un máximo de 3 480 000 y un mínimo de 410 000 (Tabla 1).
En los parámetros de la serie blanca, el leucocrito (Lc), presento un máximo de 4 y un mínimo de 1, determinándose una media de 2.76 (±0.9). El recuento por dilución de glóbulos blanco (RDB), presento una media de 64 471 (±20 590), con un mínimo de 35 400 y un máximo de 105 300. La proteína total del plasma se determino un máximo de 8 y un mínimo de 2 con un promedio de 5.48 (±1.22) (Tabla 1).
Los eritrocitos son principalmente ovales, nucleados, citoplasma es acidofilo y núcleo basofilo. Presentando un promedio de 11.49 µ (±0.75), con un mínimo de 7.5µ, y un máximo de 17.5µ. (Figura 1).
Las células reportadas para el recuento diferencial de leucocitos fueron: trombocitos, neutrofilos, eosinofilos, basofilos, linfocitos, monocitos, células plasmáticas, promielocitos mielocitos (Fig. 2). Los trombocitos presentaron una media de 46.5% (± 6.06), neutrofilos 4.5% (± 7.97), eosinofilos 3.14% (± 3.3), basofilos 3% (± 3.33), linfocitos 26.6% (± 6.36), monocitos 5.42% (± 3.24), células plasmáticas 6.56% (± 1.54), promielocitos 1.67% (± 1.6), mielocitos 0.31% (± 0.66), además hubo células que no se identificaron, estas presentaron un promedio de 1.25% (± 1.33) (Tabla 2).
Tabla 1.- Estadística descriptiva de los parámetros hematológicos de Atractosteus spatula.
Parámetro |
N |
Media
(±SD) |
Max. |
Min. |
Varianza |
Longitud (cm) |
33 |
67 (±2.969) |
72 |
60 |
8.813 |
Peso
(gr) |
33 |
2245 (±298) |
1700 |
2800 |
8.881 |
Hb
(gr/dl) |
33 |
12.45 (±2.865) |
17.00 |
5.0 |
8.21 |
Ht
(%) |
33 |
44.33 (±8.72) |
63 |
31 |
76.042 |
Lc
(%) |
33 |
2.76 (±.902) |
4 |
1 |
.814 |
PTP
(gr/dl) |
33 |
5.48 (±1.228) |
8 |
2 |
1.5 |
RDR (niles/mm3) |
33 |
1 004 000
(±562078.064) |
3 480 000 |
410 000 |
3.159E+11 |
RDB (niles/mm3) |
33 |
64 471.21
(±20590.312) |
105 300 |
35 400 |
4.240E+08 |
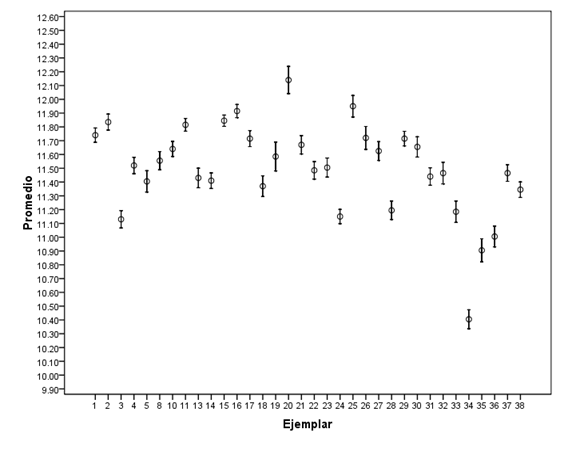
Figura 1.- Comportamiento del tamaño de los eritrocitos en cada uno de los ejemplares de Atractosteus spatula muestreados.
Tabla 2.- Estadística descriptiva del recuento diferencial de leucocitos en A. spatula
Tipo Celular |
Media
(±SD) |
Max. |
Min. |
Varianza |
Trombocitos |
46.5 (±6.064) |
62 |
31 |
36.771 |
Neutrofilos |
4.5 (±7.977) |
28 |
0 |
63.629 |
Eosinofilos |
3.14 (±3.305) |
16 |
0 |
10.923 |
Basfilos |
3.00 (±3.286) |
14 |
0 |
10.800 |
Linfocitos |
26.61 (±6.366) |
41 |
8 |
40.530 |
Monocitos |
5.42 (±3.246) |
13 |
0 |
10.536 |
Células Plasmáticas |
6.56 (±2.455) |
11 |
2 |
6.025 |
Primielocitos |
1.67 (±1.604) |
6 |
0 |
2.571 |
Mielocitos |
0.31 ±0.668 |
3 |
0 |
0.447 |
N.I. |
1.25 ±1.339 |
5 |
0 |
1.793 |
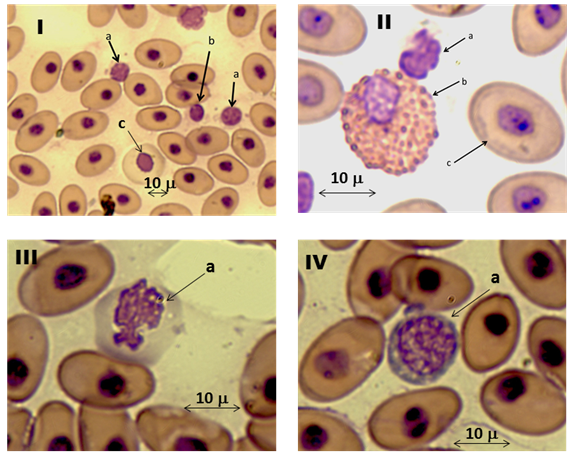
Figura 2.- Células sanguíneas, I a: linfocito, b: trombocito, c: eritrocito inmaduro; II a: trombocito, b: eocinofilo, c: eritrocito normal; III a: monocito; IV a: linfocito.
Conclusión
Los valores de Hemoglobina reportados en el presente trabajo para Astractoteus spatula, son mayores que los reportados para otras especies (Jamalzadeh y Ghomi, 2009; Galeano, 2010; Akinorotimi,2010), pero menor que las reportadas para dos especies de Acsipenser (Beker,2005). Para el parámetro de Hemoglobina los valores de Astractosteus spatula son iguales a los reportados para Salmon trutta caspius (Jamalzadeh y Ghomi, 2009), pero mayores para otras especies (Galeano, 2010; Akinrotimi, 2012; Beker, 2005). La Proteína Total del Plasma en ligeramente alta para Astractosteus spatula, que la reportada por Galeano, 2010 y por Álvarez-Mendoza. El valor encontrado para el recuento de glóbulos rojos esta dentro del los reportados para otras especies (Jamalzadeh y Ghomi, 2009; Galeano,2010; Akinorotimi,2010), sin embargo el recuento por dilución de glóbulos blancos no coincide con lo encontrado por los autores antes mencionados.
Para el recuento diferencial de leucocitos se reportan mas tipos celulares que para otras especies, pero los trombocitos son las células que predominan, habiendo diferencia en cuanto a los valores porcentuales de linfocitos y neutrofilos (Jamalzadeh y Ghomi, 2009; Akinorotimi, 2010).
Se concluye que los valores hematológicos reportados en el presente trabajo para Astractosteus spatula están dentro de los rangos de otros peces y pueden ser usados de referencia para futuras investigaciones en el campo de la contaminación ambiental.
Bibliografía
Adeyemo, O.K. Naigaga I. & Alli, R.A. (2009). Effect of handling and transportation on Heamatology of Catfish (Clarias gariepinus). J. of Fisheries Sciences.com 3(4), 333-341.
Agrawal, S.J. Srivastava, K. (1980). Hematological reponses in fresh water fish to experimental manganeso poisoning. Toxicology. 17, 97-100.
Akinrotimi, O.A.; Abu, O.M.G.; Bekibele, D.O.; Udeme-naa, B. and Aranyo, A.A. (2010). Haematological Characteristics of Tilapia guineensis from Buguma Greek, Niger Delta, Nigeria. EJEAFChe, 8, 1415-1422.
Alvarez-Mendoza FJ. (1997). Evaluación hematológica de tres especies de peces, Ictalurus punctatus, Morone saxatilis y Micropterus salmoides, en condiciones de desnutrición. Tesis de maestría (inédita) 1-69.
Beker,D.W.; Wood, A.M.; Lituak, M.K. & Kieffer, J.D. (2005). Heamatology of juvenile Acipenser oxyrinchus and Acipenser brevirostrum at rest and following forced activity. J. of Fish. Biol. 66, 208-221.
Cameron TN. (1970). The influence of environmental variables on the hematology of pingfish (Lagodon rhomboids) and striped Mullet (Mugil cephalus). Biochemic. Physol. 32, 175-193.
Christensen G M, McKim JM, Brungs WA, Hunt EP. (1972). Changes in the blood of the Brown Bullhead (Ictalurus nebulosus) Following short and long term exposure to cooper (II). Toxicology and Applied Pharmatology. 23, 417-427.
Contreras-Balderas, S. & Ruiz-Campos, G. (2010) Sistemática y Distribución de Catanes, Pejes Lagarto y Agujas (Familia Lepisosteidae) en México. In: Biología, Ecología y Avances en el cultivo del catán Atractosteus spatula. Eds. Mendoza-Alfaro, Aguilera-González y Montemayor-Leal.
Galeano, N.A.; Prat, M.I.; Gualiardo, S.E.; Schwerdt, C.B. & Tanzola, R.D. (2010). Características hematológicas Porichthys porosissimus (Pisces: Batrachoidiformes) en el estuario de Bahía Blanca, Argentina. Analecta Vet. 30(1), 5-11.
Garofano J S, Hirshfield H I. (1982). Peripheral Effects of Cadium on the Blood and Head Kidney in the Brown Bullhead (Ictalurus nebulosus). Bull Environm de Contam. Toxicol. 28, 552-556.
Jamalzadeh, H.R. and Ghomi, M.R. (2009). Hematological parameters of Caspian salmon Salmon trutta caspius associnted with age and season. Marine and Freshwater Behaviour and Physiology. 42 (1), 81-87.
Lemly AD. (2002). Symptoms and implications of selenium toxicity in fish: the Belews Lake case example. Toxicology 57 (1-2), 39-49.
Lohner TW, Reash RJ, Ellen V. (2001). Assessment of Tolerant Sunfish Populations (Lepomis sp) Inhabiting Selelenium-Laden Coal Ash Effluents. 1. Hematological and Population Level Assessnent. Ecotoxicology and Enviromental Safety. 50 (3), 203-216.
Tomasso JR, et al. (1981). Effects of Environmental, pH and calcium on ammonia toxicity in channel catfish. Transactions of the American Fisheries Society. 109, 229-234.
Wedemeyer GA, Yasutake WT. (1977). Clinical Methods for the assement of the effects of Environmental Stress in Fish Healt. Technical papers of the U.S. Fish and Wildlife Service, Number 89 pp: 1-8.
Wydosky RS, Wedemeyer GA., (1976). Problems in the physiological monitorning of wild fish populations. Stress in Fish Health. Technical papers of the U.S. Fish and Wildlife service; Number 89 pp: 1-8.